题目:Differential impacts of water diversion and environmental factors on bacterial, archaeal, and fungal communities in the eastern route of the South-to-North water diversion project
摘要:
Water diversion homogenized microbial communities.Microbial community stability reduced during the water diversion period (WDP)Bacterial and fungal assembly processes were more stochastic during the WDP.Water diversion primarily shaped bacterial assembly processes and functional guilds.Environmental factors had a greater influence on archaeal community.
DOI:
10.1016/j.envint.2025.109280
原文链接:https://doi.org/10.1016/j.envint.2025.109280

摘要: 调水工程有效缓解了水资源分布不均的问题,但也影响了水生生物多样性和生态系统功能。基于高通量测序,该研究探究了南水北调东线输水干渠细菌、古菌和真菌在非调水期和调水期的群落动态。结果表明,在调水期,细菌和古菌群落中存在竞争排斥,表现为物种丰富度下降、生物量增加,而真菌生物量则显著下降。距离衰减关系表明微生物群落的分布在调水期呈现均质化。群落稳定性在调水期降低。其中,调水是影响细菌群落稳定性的主要因素,而环境因子对古菌和真菌群落的影响更大。在调水期,以均质化扩散和漂移为主的随机过程对细菌和真菌群落构建的贡献增大。在调水期,细菌群落功能多样性下降,化能异养和具有有机化合物分解代谢功能的细菌相对丰度增加,而光能自养细菌减少。偏最小二乘路径模型表明,调水主要影响细菌构建机制和代谢功能,而环境因子对古菌群落的影响更大。这项研究为调水和环境波动如何影响调水工程中不同微生物群落的构建过程和代谢功能提供了全面的见解。
调水工程通过输水渠道将水资源输送到缺水地区,实现水资源的重新分配,从而提高水资源利用效率。然而,调水工程会加强不同流域之间的连通性,进而引发水文条件变化,破坏生态系统的稳定性,扰乱生物多样性,威胁水生生态健康。因此,深入了解调水对自然水生态的影响,对于预测和应对这些风险至关重要。
微生物群落在生物地球化学循环中发挥着至关重要的作用。在水生生态系统中,细菌、古菌和真菌等多种微生物共存。它们的组成和代谢功能受环境因子、时空变化以及微生物相互作用等多重因素的影响。研究表明,调水工程通过招募分散的物种,增加了渠道中的细菌多样性,并改变了微生物群落结构。同时,调水和沉积物扰动导致的渠道水文条件的变化会影响物种的生长。另一方面,微生物的构建受确定性因素(如环境过滤和物种相互作用)和随机过程(如生态漂移和扩散)共同作用。调水可能导致水体中的微生物群落构建机制的变化。深入了解调水对微生物群落结构、构建机制和功能的影响,对于保障水生生物的安全至关重要。
该研究探讨了南水北调东线输水干渠中细菌、古菌和真菌群落在非调水期和调水期的时空分布动态及其与环境因子的相关性。该研究旨在评估调水的影响:(1)细菌、古菌和真菌群落的时空分布和稳定性;(2)微生物群落的构建机制;(3)群落功能的变化及其潜在机制。该研究为了解调水期间调水工程渠道中多域微生物行为的变化提供了全面的见解。
主要发现
1. 微生物群落时空分布
在非调水期和调水期期间采集的55个样品中,共观察到23,053个细菌(1.2×105‒1.5×107 copies/mL)、5607个古菌(1.1×102‒1.4×104 copies/mL)和10,252个真菌OTU(7.4×103‒2.4×106 copies/mL)。非调水期和调水期中细菌的优势门均为放线菌门(5.4×104‒7.7×106 copies/mL)、变形菌门(1.3×104‒4.2×106 copies/mL)和蓝藻门(1.0×104‒1.7×106 copies/mL);古菌的优势门均为泉古菌门(46.5‒9.5×103 copies/mL)、嗜盐菌门(20.2‒1.8×103 copies/mL)和广古菌门(18.4‒9.9×102 copies/mL);真菌的优势门均为未分类门(4.2×103‒6.6×105 copies/mL)、壶菌门(5.9×102‒5.2×105 copies/mL)和子囊菌门(5.6×102‒1.2×106 copies/mL)(图1a)。

图1 细菌、古菌和真菌群落组成、绝对丰度以及群落丰富度和生物量在非调水期和调水期的沿程分布(a)。基于 Bray‒Curtis 差异的非度量多维标度(NMDS)分析(b)。相似性分析(ANOSIM)的 p 值表明微生物组成差异的显著性。
与非调水期相比,调水期期间细菌和古菌丰富度(物种数量)均显著下降(p < 0.001,图 1a)。然而,细菌生物量(总绝对丰度)显著增加(p < 0.001),而古菌生物量保持稳定(p > 0.05)。这种转变主要归因于竞争排斥,其中少数优势微生物物种在环境干扰期间利用了可用资源。相比之下,真菌的丰富度波动不大,但与非调水期相比,调水期期间的生物量显著下降(p < 0.05),表明特定真菌物种的生长受限。此外,NMDS分析显示非调水期和调水期之间细菌(ANOSIM,p = 0.001)和真菌(p = 0.003)群落的组成存在显著差异(图1b),表明调水期期间微生物群落内存在物种更替。
在非调水期和调水期期间,细菌、古菌和真菌群落均表现出显著的距离衰减关系(p < 0.001,图 2a)。与非调水期相比,调水期期间三种群落的地理距离衰减程度都更低。此外,根据采样点的空间分布,将河道分为两段:第 I 段:S01–S16 和第 II 段:S17–S30。在非调水期期间,两段的古菌组成(图 2b)和细菌、古菌和真菌 α 多样性指数(丰富度、香农和/或辛普森指数,图 2c)存在显著差异(p < 0.05),但在调水期期间未观察到此现象(p > 0.05)。这表明调水期期间微生物分布呈现均质化。
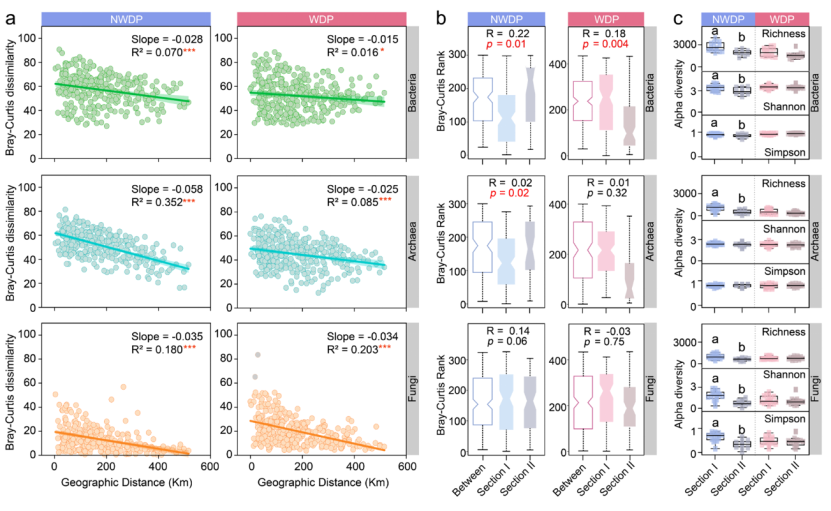
图2 细菌、古菌和真菌群落的空间变化。基于 Bray‒Curtis 相似性的微生物群落距离衰减曲线(a)。ANOSIM 显示两个河道段之间的组成差异(b)(河道 I 段:S01–S16 和河道 II 段:S17–S30)。ANOSIM 的检验统计量 R和显著性水平(p)展示了两个河段之间的微生物组成差异。非调水期和调水期期间两个河段的丰富度、香农指数和辛普森指数(c)
2. 微生物群落稳定性
为了评估网络稳定性,构建了基于OTU的Spearman相关性分析的细菌、古菌或真菌的共现网络(图 3a)。通过移除微生物节点来模拟物种灭绝改变网络连接来表征微生物群落稳定性。结果表明,与非调水期相比,调水期期间微生物自然连通性随着移除节点的比例而下降得更快(图3b)。这表明在调水期期间微生物群落抵抗性降低,即网络稳定性降低。这可能是由于微生物群落重新构建过程中物种的快速更替所致。

图3 细菌、古菌和真菌在非调水期和调水期期间的单域共现网络(a)。稳健性分析展示了微生物自然连通性与移除的微生物节点比例之间的关系(b)。方差分解分析(VPA)显示了调水和环境因子对细菌-古菌-真菌群落稳定性的影响(c)。
方差分解分析结果表明,调水和环境因子均影响微生物群落稳定性(即平均变异程度,图4c)。调水解释了16%的细菌群落稳定性变量,而环境因子仅解释了4%(图4c)。相比之下,环境因子解释了68%和37%的古菌和真菌群落稳定性变量,而调水分别解释了5%和20%。这些结果表明,调水期间的环境变化是古菌和真菌群落构建机制的潜在驱动因素。线性回归分析进一步支持了这些发现。
3. 微生物群落构建模式
在非调水期期间,细菌和古菌群落的构建模式相似,顺序为同质选择(确定性过程,细菌60.0%和古菌58.7%) > 随机过程(32.0%和26.3%)> 异质选择(8.00%和15.0%)(图4a)。相比之下,在调水期期间,细菌群落构建主要由随机过程(51.7%)和异质选择(31.7%)驱动(图4a)。零模型分析显示,漂移(27.4%)和均质化扩散(18.6%)是影响调水期期间细菌群落构建的重要因素(图4b),这归因于调水导致的水生连通性增强。对于古菌,确定性过程在调水期期间更为突出(异质选择占比93.3%,图4b)。这种转变表明调水期的环境选择作用高于扩散,这使古菌群落构建机制更确定化。这表明古菌相较于细菌更容易受到环境选择压力的影响,这一结果与其较窄的生态位相对应(p < 0.05)。
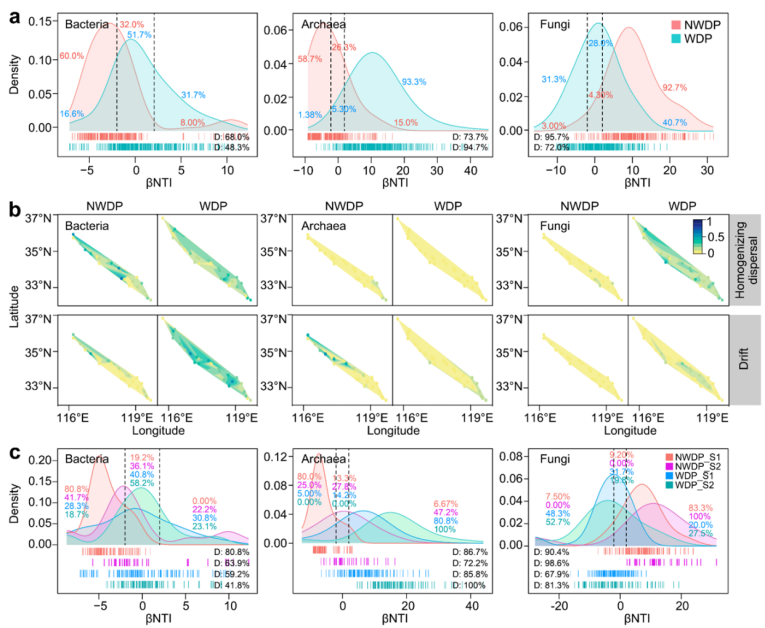
图4 微生物群落构建模式的时空变化(a)。|βNTI| > 2 和 < 2 分别代表确定性(异质性和同质性选择)和随机性。不同采样点的均质化扩散和生态漂移的相对重要性(b)。河段I和河段II中的微生物群落构建模式(c)。
与细菌和古菌群落相比,真菌群落表现出不同的群落构建过程(图 4a)。异质性选择在塑造非调水期(92.7%)和调水期(40.7%)真菌群落方面发挥了重要作用,表明渠道中真菌的构建模式更具确定性。这可能是由于部分真菌能够附着在环境介质上,导致其群落构建的随机性低于原核生物。尽管如此,在调水期期间,调水导致的均质化扩散(21.4%)驱动的随机过程(28.3%)对真菌群落构建的影响增加(图4a‒b)。此外,三种微生物群落构建机制在两河段的差异在调水期减小(图4c)。这表明调水导致群落构建过程的同质化,这主要是由于水体连通性和流动性增加所致。
4. 微生物群落代谢功能
在非调水期期间,从9239个细菌和1622个古菌OTU中预测出72个细菌和16个古菌代谢功能组。在调水期期间,从7158个细菌和1083个古菌OTU中预测出74个细菌和14个古菌功能组。在调水期,细菌功能多样性显著降低(p < 0.05)。在非调水期,具有光自养和化学异养的细菌得到富集(图5a)。然而,化学异养和好氧化学异养在调水期成为主导(图5a)。这种转变归因于异养细菌(如放线菌、变形菌和拟杆菌等)的相对丰度增加,以及自养细菌(如蓝藻细菌)的减少(图5b)。此外,参与有机化合物分解代谢的细菌类群,包括芳香族化合物和脂肪族非甲烷烃降解菌(Verrucomicrobiota和/或放线菌)在调水期期间显著增加(p < 0.001,图5b),增强了有机碳降解并促进了碳循环。同时,调水期期间具有尿素分解功能细菌的丰度增加表明放线菌等细菌对有机氮的利用能力更强(图5a)。
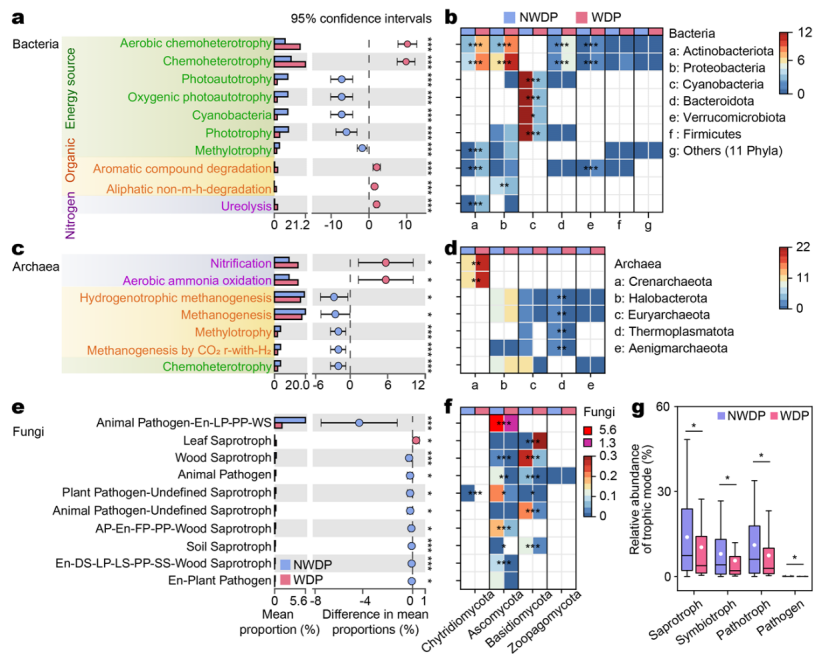
图5 细菌(a)、古菌(c)和真菌(e)群落代谢功能在非调水期(蓝色)和调水期(红色)期间的差异分析。主要细菌(b)、古菌(d)和真菌(f)门与特定功能组相对应的相对丰度。四种营养型相对应的真菌类群的相对丰度(g)。
调水期期间,参与反硝化和有氧氨氧化的古菌类群(即 Crenarcharota)与非调水期相比表现出显著更高的丰度(p < 0.01,图 5c‒d)。这与TN和NO3--N浓度升高密切相关(p < 0.05)。相反,调水期期间与产甲烷代谢相关的功能,包括氢营养产甲烷、产甲烷、甲基营养和通过H2还原CO2产甲烷,显著降低(图5d)。此外,在非调水期和调水期期间,分别从1101个和941个真菌OTU预测出82个和78个真菌功能组(图5e)。这些OTU分为四种营养型(腐生菌、共生菌、致病菌和病原菌)(图5g)。调水期间所有四种营养型的真菌类群总相对丰度均显著下降(p < 0.05,图5g)。在分析的14个功能组中,除叶腐生菌外,13个行会的丰度显著下降(p < 0.05)(图5e)。叶片腐生菌的增加主要是由于担子菌的增加。担子菌能够产生分解落叶的木质纤维素降解酶(图5f)。
5. 微生物群落构建和代谢功能的主要驱动因素
偏最小二乘路径(PLS-PM)分析表明,调水和环境因子分别解释了86.0%、60.0%和91.0%的细菌、古菌和真菌群落构建机制(βNTI)(图 6a‒c)。调水对细菌(λ = 0.61)和真菌(λ = 0.83)群落构建的影响比环境因子(λ = 0.38, 0.22)更大。相比之下,环境因子(λ = 0.53)对古菌群落构建的影响大于调水(λ = 0.41)。这表明随机过程在调水期对细菌和真菌群落构建机制的贡献增加,而古菌群落构建受确定性过程影响增加。
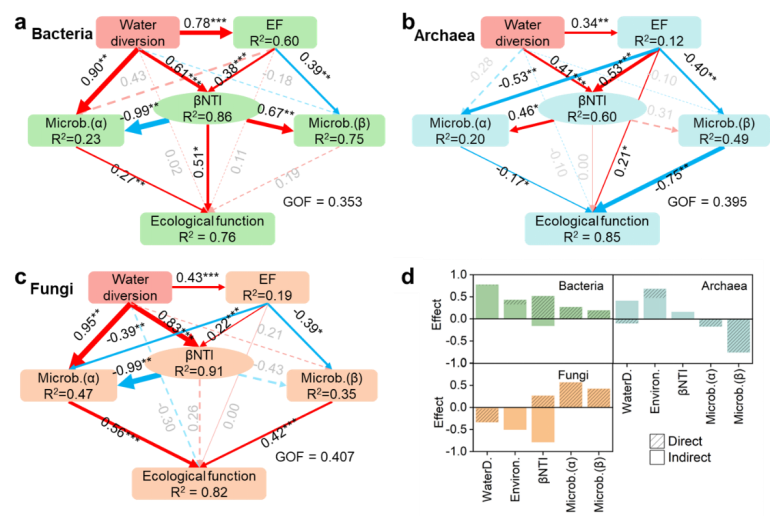
图 6 偏最小二乘路径模型(PLS‒PM)识别影响细菌(a)、古菌(b)和真菌(c)群落构建(βNTI)和功能组的驱动因素。调水、环境因子、βNTI、微生物α多样性(丰富度、香农指数和辛普森指数)和微生物β多样性对细菌、古菌和真菌功能组的直接和间接影响(d)。
非生物因素(调水和环境因子)和生物因素(βNTI、微生物α和β多样性)分别解释了76%、85%和82%的细菌、古菌和真菌功能组(图 6a‒c)。调水主要通过细菌α多样性和群落构建机制影响功能组,而环境因子则通过影响群落构建机制进而影响功能。值得注意的是,调水使细菌功能组的主要驱动因素,总效应为0.77,超过环境因子(总效应为0.43)。这表明相较于环境过滤效应,调水增加了不同栖息地之间微生物的扩散对群落的影响。这种变化可以促进物种适应变化的水环境。
相比之下,环境因子对古菌(总效应 0.68)和真菌(-0.50)功能组的影响比调水更显著(图6b‒d)。这凸显了环境过滤在塑造古菌和真菌群落方面的关键作用。与细菌相比,古菌和真菌通常占据更特殊的生态位,这使它们对环境条件更为敏感。在调水期,快速的环境波动会对物种进行过滤,这种环境过滤作用可能成为影响这些微生物群落组成和代谢功能的主导因素。
冗余分析和Mantel检验进一步评估了环境因素对两个水期中细菌、古菌和真菌群落功能的影响(图7)。Mantel检验揭示了影响三种微生物群落的环境因素,即NO3--N、NO2--N、TP、DIP、T和F-(图7c‒d)。其中,调水期间NO3--N浓度显著增加(p < 0.05),这主要是由于南四湖等湖泊中NO3--N浓度明显升高。此外,TP、DIP、T和F-浓度显著下降,这可能是由于调水工程稀释了现有污染物所致。此外,SO42-显著影响古菌功能(图7d),其可以作为电子受体促进古菌的亚硫酸盐还原功能。这些发现强调了调水期间环境波动对微生物群落功能的重大影响。
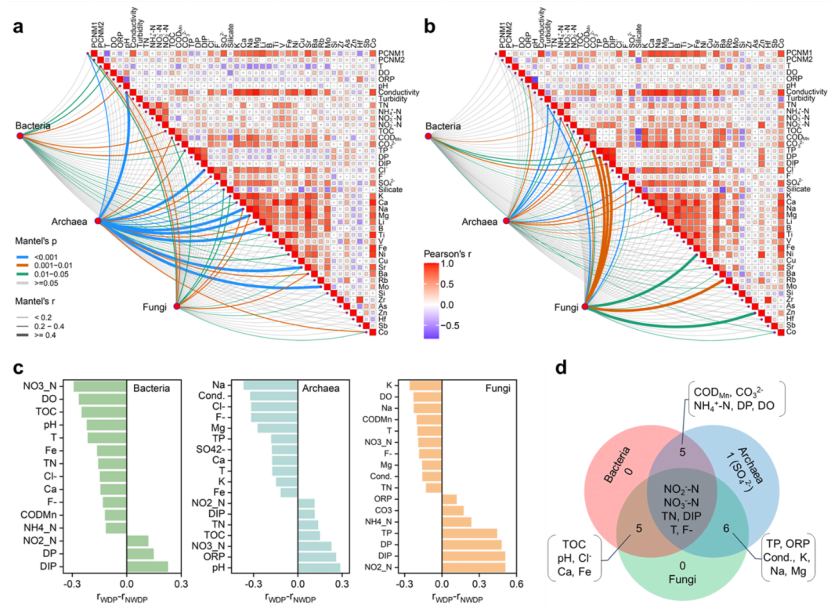
图7 环境因子对非调水期(a)和调水期(b)期细菌、古菌和真菌微生物功能的影响。重要环境因素对微生物群落功能的影响大小(c)。显著影响微生物群落的共同和独特的关键环境因素(d)。