原创 杨腾 iMeta 2022-10-15 15:56 发表于广东
点击蓝字 关注我们
真菌稳定高寒林线生态系统中的多界生物群

https://doi.org/10.1002/imt2.49
RESEARCH ARTICLE
● 2022年8月15日,中国科学院南京土壤研究所褚海燕团队在iMeta在线发表了题为“Fungi stabilize multi-kingdom community in a high elevation timberline ecosystem”的研究性论文。
● 该文章发现了多界网络的构建提高了微生物组网络的复杂性和负连接比例,真菌的存在加固了多界网络拓扑结构的稳定性,在群落水平,真菌架起了连通地上和地下生物区系的桥梁。
● 第一作者:杨腾
● 通讯作者:褚海燕 (hychu@issas.ac.cn)
● 合作作者:Leho Tedersoo;Xu Liu(柳旭);Gui-Feng Gao(高贵锋);Ke Dong(董科);Jonathan M. Adams
● 主要单位:中国科学院南京土壤研究所;中国科学院大学;爱沙尼亚塔尔图大学;韩国京畿大学;南京大学
亮 点
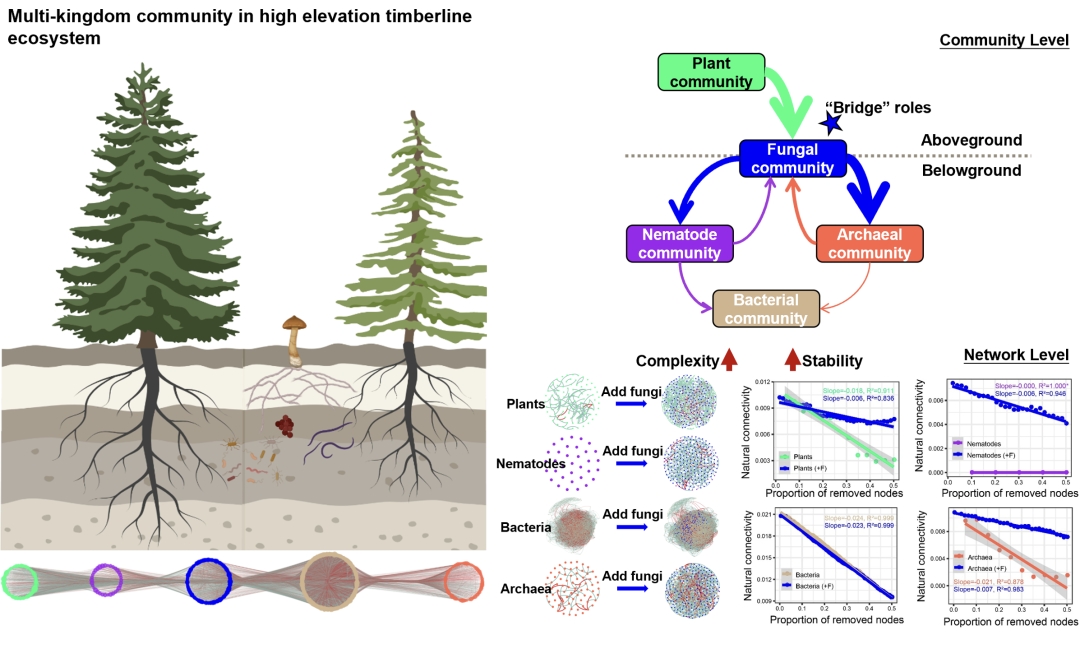
● 多界网络的构建提高了网络的复杂性和负连接比例
● 真菌的存在加固了多界网络拓扑结构的稳定性
● 在群落水平,真菌架起了连通地上和地下生物区系的桥梁
摘 要
微生物因其庞大的物种多样性和重要的生态功能在陆地生态系统中占有重要位置,如参与生物地球化学循环和菌根共生等。其中,真菌与其他生物之间组成了多样的关系网络,然而,在多界群落构成的网络系统中,来自不同生物界的物种各自发挥什么样的作用却并不清楚。在“整合微生物组”的研究倡议下,本研究采用SPIEC‐EASI及其扩展法,探寻高寒林线多界生物的互作关系,在群落和网络水平解析了植物、线虫、真菌、细菌和古菌之间的潜在联系。研究发现:相比单界网络,在多界网络及其种间关系中,界内和跨界物种连接分别增加了1012和10772条,平均连通性和负连接比例分别增加了15.2和0.8%。真菌的引入增加了生物网络的稳定性(即抵抗节点丢失的能力)和连通性,降低了模块性。在总体多界网络中,真菌节点的度(degree)和中介性(betweenness)显著高于细菌节点。真菌更多扮演了“模块连接者”的角色,维持网络的整体性。与网络分析结果相一致,结构方程模型和多元矩阵回归分析在群落水平上证明了真菌的“桥梁”作用,真菌群落一方面受到植物群落的显著影响,另一方面显著影响了其他土壤生物群落。我们的发现表明真菌能够稳定多界网络的自组装过程,同时,鼓励和倡导在自然生态系统中开展更多的多界群落研究,以此揭示地上与地下生物之间的复杂联系。
关键词:多界网络,真菌,林线生态系统,连通性,模块性,稳定性
视频解读
,时长06:19
全文解读
引 言
森林是陆地生态系统中最大的碳库,可有效地吸收大气中二氧化碳,在减缓全球变暖中发挥关键作用,据报道,2001-2010年间全球森林固碳21.5 Pg。此外,森林在木材生产、水土保持和生物多样性保护等方面也发挥着极为重要的作用。由于人类活动和气候变化,森林生态系统正遭受砍伐、火灾、干旱及病虫害爆发的严重干扰,而森林生态系统对这些干扰的响应很大程度上受到植物和土壤生物相互关系的影响。地下生物多样性塑造地上生物多样性,并驱动生物地球化学过程,因此系统地研究森林土壤生物群落的特征和结构至关重要。
网络理论及其应用极大地提高了我们对“复杂系统”的认识。网络分析不仅可以描述微生物与宿主的共存模式,而且可以拆解微生物-微生物、微生物-宿主的相互关系。基于网络分析,我们可以确定对群落构建和生态功能起重要作用的关键物种和主要模块,并推断生物互作对生态系统稳定或宿主健康的显著影响。
最近,“整合微生物组”概念的提出被认为是未来微生物组研究的重要方向,其包括了对所有原生生物、真菌、细菌、古菌和病毒的综合研究。相应的,多界网络分析恰恰能够阐明同一区域内不同界的微生物共存模式的差别,同时揭示不同类群在多界生物群落中的作用。在青藏高原,先前研究发现古菌在构建土壤微生物共生网络中起关键作用,古菌的缺失会造成整个网络自然连通性的下降。在例如人肺、皮肤及受干旱胁迫的草地等生态系统中,真菌被报道在维持网络稳定性方面发挥重要作用。
受控于温度和水分,树木在高山或高原森林上界形成特殊的分布界线——高寒林线。高寒林线对气候变化和人类活动高度敏感。通常情况下,高寒林线并不是一条清晰的线,而是从密闭森林向高山苔原/草地的过渡地带。值得注意的是,通常只有1-2种树木覆盖整个林线区域。外生菌根(EcM)真菌在温带和北方森林中与林线树种相伴而生,显著提高了宿主植物对水分和养分(主要是氮素)的吸收,进而拓展了植物的生存范围。除了EcM真菌,林线区域还含有大量的地下或土壤表面的其他真菌(称为非外生菌根(non-EcM)真菌),如凋落物中的腐生真菌、根-土界面上的丛枝菌根真菌(AMF)以及非菌根类型的内生真菌。如此多样的真菌群落共同构成了一个复杂且先进的地下真菌网络,进而驱动植物种群和群落的形成及土壤养分的周转。尽管地下真菌群落功能强大,然而我们对地下真菌群落及其与其他土壤生物的相互关系的认识仍然十分匮乏,特别是在高山林线生态系统中。
长白山岳桦林是东北亚保存最为完好的高山森林之一。林线树种岳桦(Betula ermanii Cham.)在高山森林的上界有着约450 m的垂直分布范围。在本研究中,我们沿着岳桦在长白山的天然分布区调查了树木根基土壤中的多界生物群落,包括线虫、真菌、细菌和古菌,构建多界生物共存网络(包括植物、线虫、真菌、细菌和古菌),并解析不同界的生物类群在总网络中的作用。提出如下假设:(1)相比单界网络,多界网络的构建将显著增加网络复杂度和负连接比例,这是因为营养级复杂度提高,种间竞争加剧。例如,线虫的引入将增加捕食者-被捕食者的关系(如植食性线虫、食真菌线虫和食细菌线虫),进而提高食物网营养级的复杂程度。在森林中,EcM真菌能帮助植物与土壤中非共生生长的微生物竞争有限的氮元素。这种高阶相作,即某个物种的存在影响其他物种之间的相互作用,已被证明可以维持竞争网络模型的稳定性。(2)考虑到林线系统中真菌生物量和菌根/菌丝网络的优势程度,真菌类群将对多界网络的稳定和连接起关键作用。此外,EcM真菌相比non-EcM真菌在稳定多界网络中将发挥更重要的作用。(3)基于已有报道中真菌和其他生物(包括植物)的群落组成的紧密联系,真菌群落将成为多界生物群落连接的“桥梁”,即真菌群落组成将显著影响植物和其他土壤生物群落,反之亦然
结 果
多界和单界网络的比较
本研究采用多引物靶标,构建得到植物、线虫、真菌、细菌和古菌的多界和单界网络(图1)。单界网络连接(边)数分别为植物88条、线虫0条、真菌286条、细菌15824条、古菌50条。多界网络包括1550个节点和28032条边,其中跨界连接占38.4%,负连接占35.3%。在单界网络中,细菌和真菌网络拥有最大的节点数、边数和平均连通性,但模块性最低 (表1)。植物和真菌网络的负连接比例低(<10%),而细菌和古菌网络的负连接分别为34.9%和28.0%。相比单界网络,多界网络中的界内网络的内部连接数和平均连通性分别提高了1012和0.6,负边比例也提高了2.9% (表2, 图1和2)。特别是,真菌的界内网络结构的变化最为显著:平均连通性从3.2增加到8.7,负边比例从8.0%增加到29.7%。
在多生物界网络中,根据节点数、边数和平均连通性的比较,真菌和细菌是最大的两个生物界(表2)。在节点水平,真菌节点的标准化后的度(degree)和中介性(betweenness)显著高于细菌节点,线虫节点的度和中介性在所有生物界中最高 (图3)。EcM和non‐EcM真菌的标准化后的度和中介性没有显著差异 (图S1)。z‐c图展示了植物、线虫、真菌、细菌和古菌节点在多界网络结构中扮演的角色 (图 S2),具体的,“连接节点”(connector)的数目分别为植物13个、线虫4个、真菌41个、细菌296个和古菌27个。表S1则总结了41个真菌连接节点的分类和功能信息。41个真菌连接节点中有20个节点为EcM真菌,包括丝膜菌属(Cortinarius,9个节点)、红菇属(Russula,4个节点)、口蘑属(Tomentella,4个节点);此外,7个节点属于腐生霉菌——被孢霉属(Mortierella),5个节点属于AMF球囊菌门(Glomeromycota)。在其他生物中,两个“网络中心节点”(network hub),包括未培养的Thermoplasmata和地杆菌,和一个“模块中心节点”(module hub),即亚硝化球菌,也被检出。植物和线虫群落中无网络和模块中心节点。
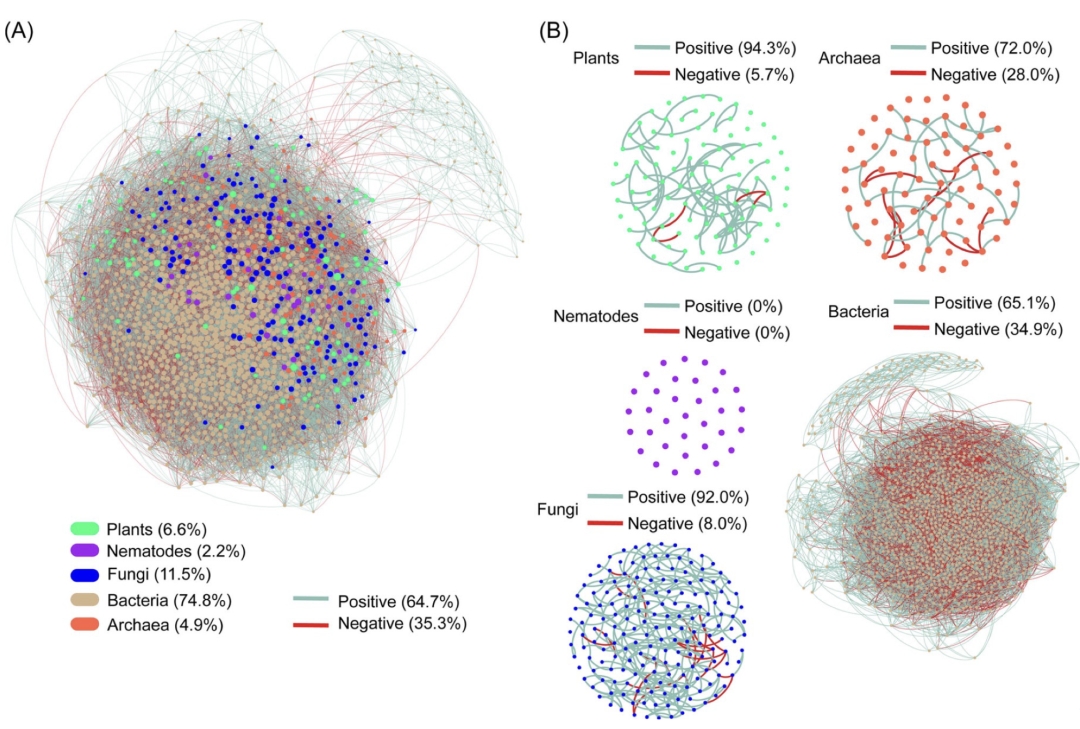
图1. 长白山林线生态系统多界(A)和单界(B)共存网络
其中,线虫的单界网络无连接
表1. 多界和单界网络的拓扑结构特征
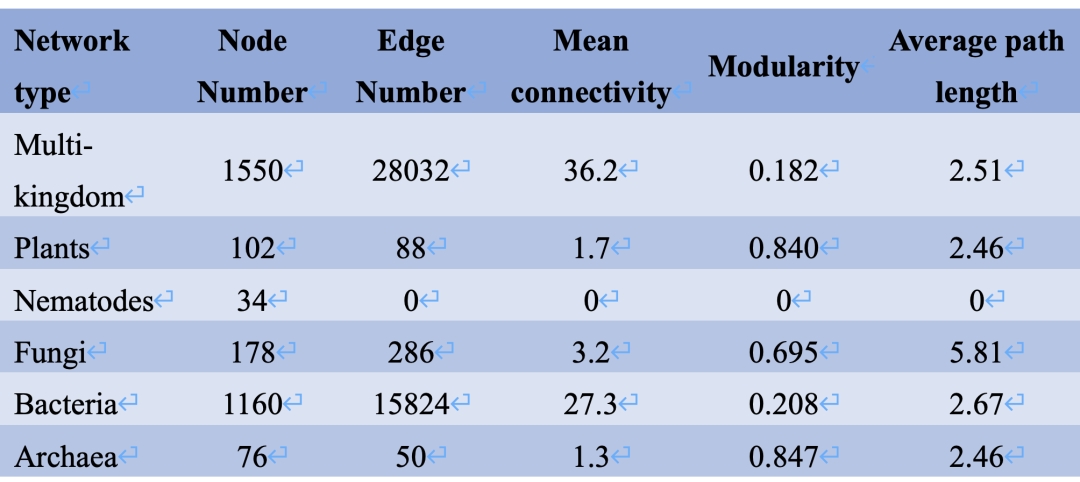
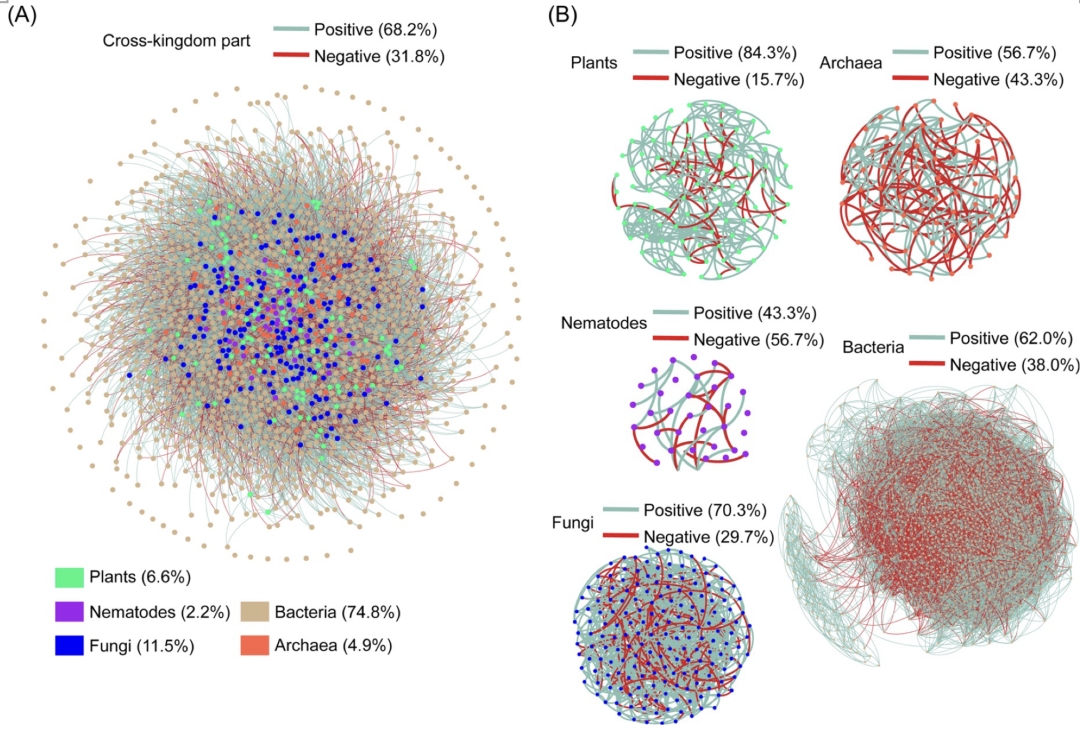
图2. 对多界网络的拆解
(A)跨界部分展示了多界网络中所有的跨界连接,如植物-真菌、真菌-细菌和细菌-古菌的连接。(B)五个界内部分展示了多界网络中所有的界内连接,包括植物-植物、线虫-线虫、真菌-真菌、细菌-细菌和古菌-古菌的连接
表2. 单界网络与多界网络中界内连接部分的拓扑结构特征比较
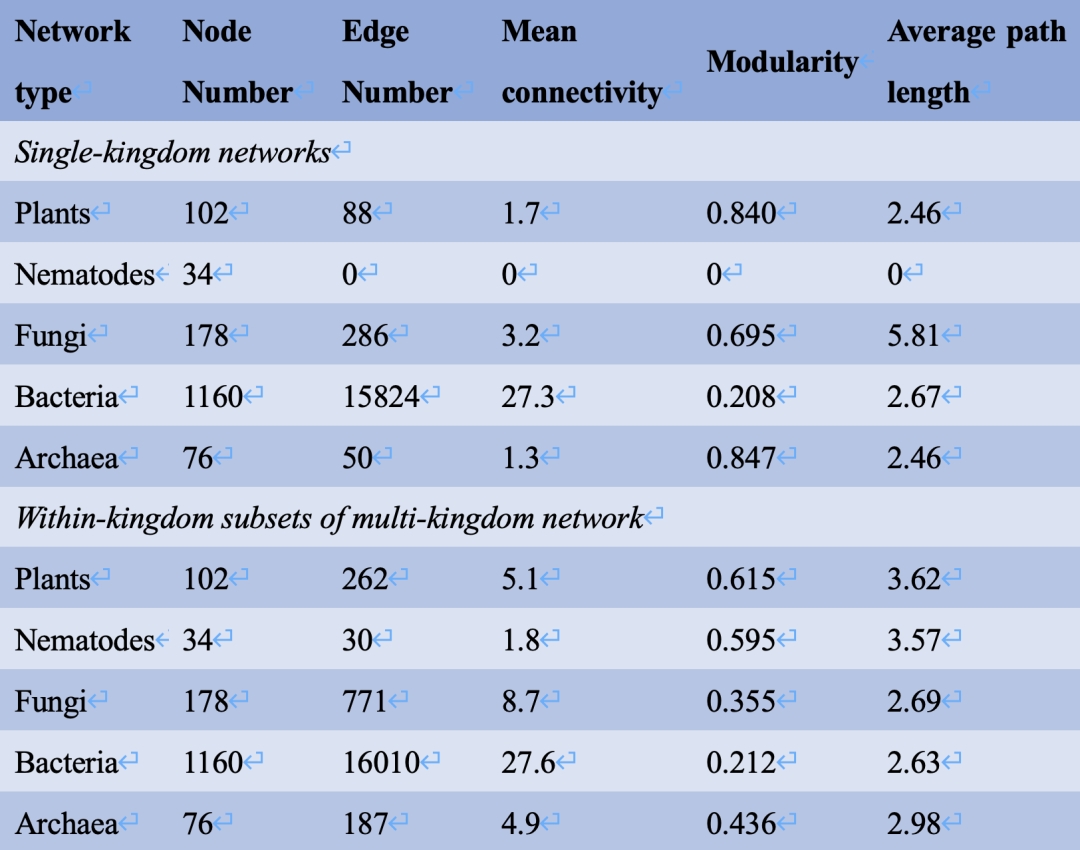
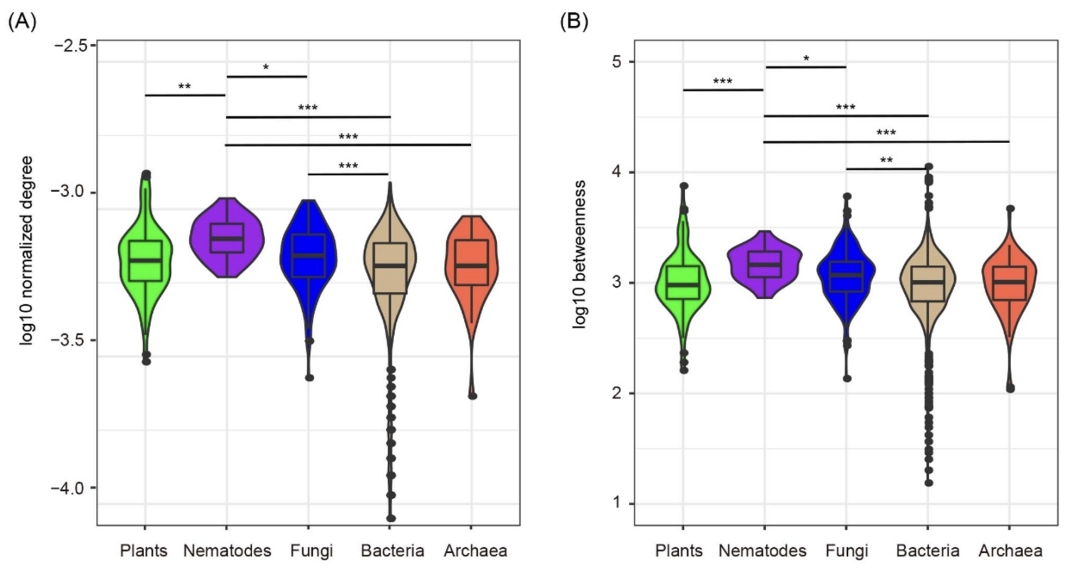
图3. 多界网络中植物、线虫、真菌、细菌和古菌的度和中介性的比较
(A)度连接用log10的标准化后的度表示,(B)中心性由log10的中介性表示。
真菌和其他生物界类群在多界网络中的作用
我们检测了真菌和其他生物界类群的添加和缺失对共存网络稳定性的影响,发现在植物、线虫、细菌和古菌的单界网络中加入真菌后,网络变得更加紧密且模块化程度降低 (图4A,表S2)。细菌网络的加入有着类似于真菌网络加入的效果,然而,无论是线虫还是古菌的加入都没有类似的效果 (表S3–S5)。特别是,真菌的添加显著提高了植物、线虫和古菌网络的稳定性 (图4B),例如,随着节点丢失,植物和古菌单界网络的自然连通性逐渐降低,其下降速率(斜率)分别为-0.018和-0.021,但是当加入真菌网络后,其斜率提高到-0.006和-0.007。在真菌网络中添加线虫、细菌、古细菌时,真菌网络的稳定性并没有被提高 (图S3), EcM和non‐EcM真菌的分别加入也显著提高了植物、线虫和古菌网络的稳定性(图S4),但添加EcM和non‐EcM真菌对网络拓扑结构的影响相近 (表S6)。
植物-真菌网络具有非常大的正连接比例(>92.2%),暗示林线生态系统中植物和真菌关系以互利共存占主导。在所有单界网络中,真菌网络的自然连通性的斜率绝对值最低((slope = −0.005; 图S5A)。当把真菌从整个多界网络中去除后,自然连通性(图S5B)、边数、平均连通度均降低,但模块性升高 (表S2)。另一方面,只有植物、真菌、古菌网络的移除降低了整个多界网络的稳定性,其中真菌移除导致最低的自然连通性(图S5B)。在EcM和non-EcM真菌的独立网络中,两者的稳定性无显著差异;在多界网络中去除EcM和non-EcM真菌,网络稳定性的变化也不因功能类群的不同而改变。唯一的区别可能是,与non-EcM真菌相比,EcM真菌网络连接更加紧密(图S6)。
真菌与其他界生物类群之间有5487条连接,占跨界连接总数的50.9%(图5)。基于植物和其他土壤生物(不包括真菌)的节点数,真菌与植物、线虫、细菌和古菌的连接比例的预期值分别为7.4%、2.5%、84.5%、5.5%,然而实际的连接比例分别为13.8%、4.5%、72.7%、9.0%(图5)。真菌与植物和古菌连接中的正连接比例分别达到最高的77.5%和最低的59.2%。此外,基于零模型比较,腐生真菌和EcM真菌连接中的负边界比例显著高于其他真菌类群之间的连接 (图S7)。
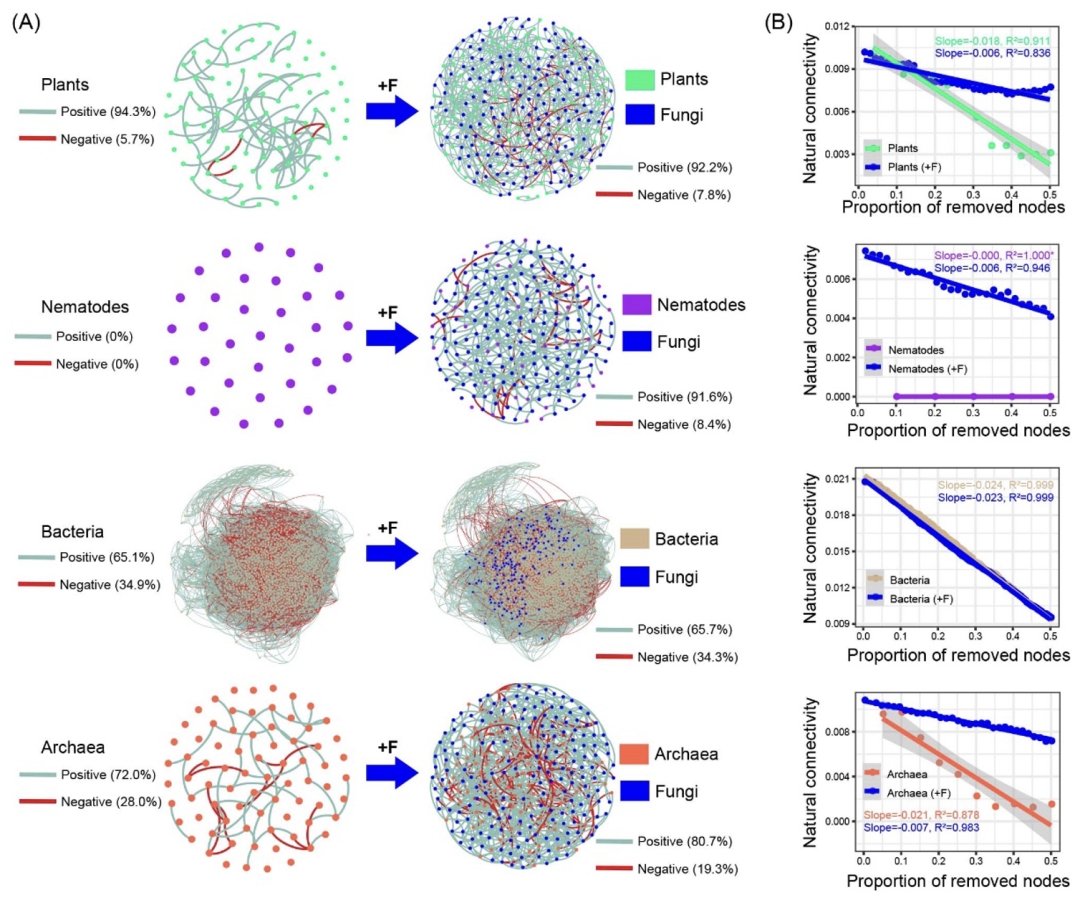
图4. 真菌网络的加入对植物、线虫、细菌和古菌的单界网络的影响
(A)随着真菌网络的加入,网络拓扑结构的变化。(B)随着真菌网络的加入,网络稳定性的变化。用50%的节点损失拟合自然连通性的递减趋势,图中显示了R2和斜率。斜率的绝对值越小,网络越稳定。“+F”表示在单界网络的基础上加入真菌网络
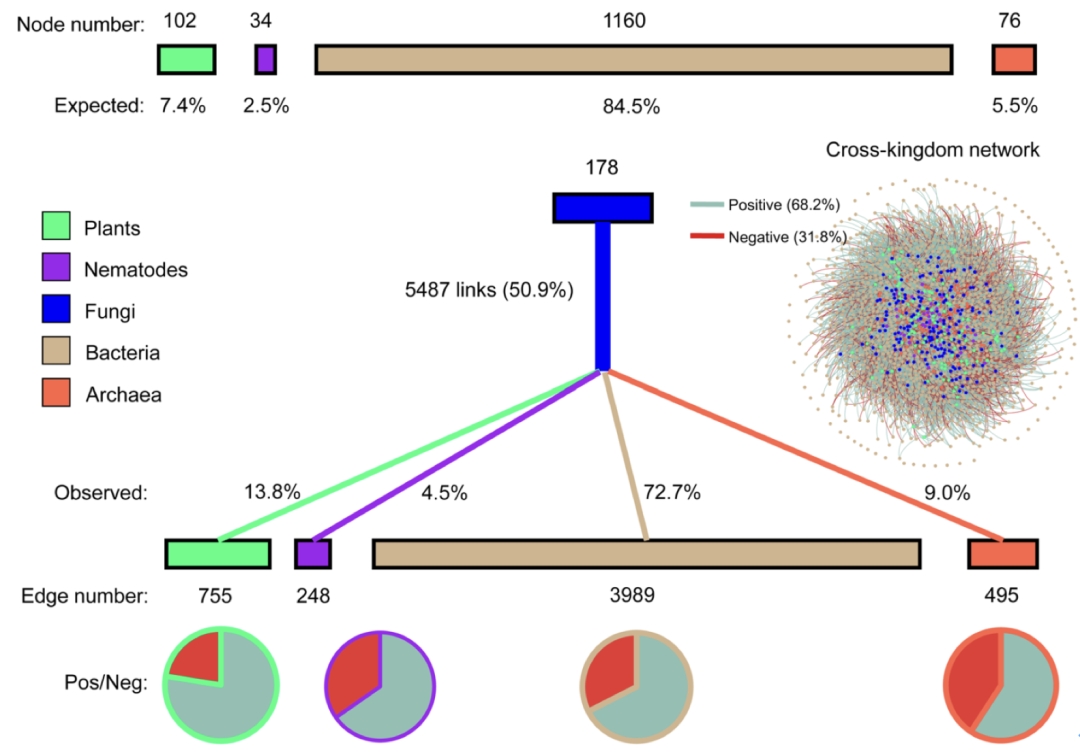
图5. 网络跨界连接部分中与真菌有关的连接
真菌与其他生物类群连接的期望比例基于植物、线虫、细菌和古菌的节点数。观察到真菌连接的比例基于实际的连接数量。正连接(青色)和负连接(砖红色)的比例在图下方以饼图形式展现
真菌和其他生物界类群在群落水平的联系
将40个非共线性环境因子(图S8)、地理距离和邻近植物群落作为预测因子,我们构建了基础的多元矩阵回归 (multiple regression on matrices - MRM),以确定线虫、真菌、细菌和古菌群落组成的驱动因子(表S7)。结果表明:土壤pH 是线虫群落组成的最强预测因子,解释了20.1%的群落变化;真菌群落组成主要受植物群落组成、土壤pH和电导率的影响;土壤pH和有效镁共同解释了17.3%细菌群落的变化;古细菌群落组成主要受邻近树木丰富度和土壤总铁含量的影响。当加入土壤生物群落组成作为预测因子后,完整的MRM解释了更多的线虫、真菌和古菌群落的变化(表S8)。真菌群落强烈地影响了线虫和古细菌群落的组成 (p = 0.001)。真菌群落组成成为古菌群落组成的最强驱动因子(表S8)。巧合的是,线虫和古菌的群落组成也显著影响了真菌的群落组成,植物群落组成仍然是驱动真菌群落组成的最强因子(表S8)。
结构方程模型展示了相似的规律。植物群落组成强烈且直接地影响真菌群落组成,并通过影响真菌群落组成间接影响其他土壤生物群落(图6)。基于标准化路径系数(SPC),真菌群落与植物和古细菌群落高度相关联(SPC=0.73)。此外,植物群落直接影响土壤pH,并通过影响pH值间接影响线虫、真菌、细菌和古菌的群落(图6)。
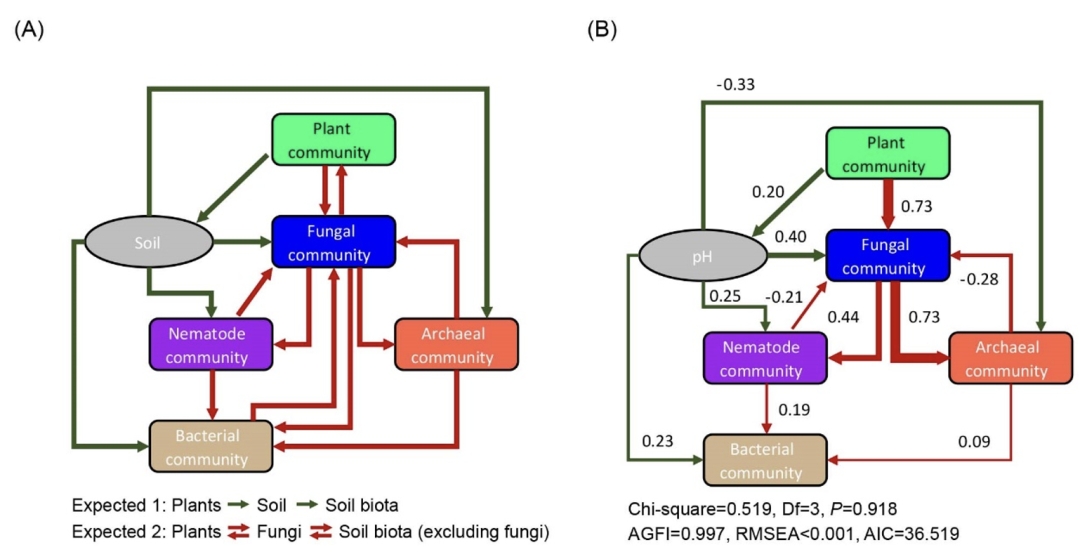
图6. 结构方程模型(SEM)揭示群落水平的多界生物类群的互作
(A)先验模型基于以下两个假设:一是植物群落通过影响土壤属性驱动土壤生物群落;二是真菌群落影响植物和其他土壤生物群落,同时植物和其他土壤生物群落也显著影响真菌群落。(B)基于赤池信息准则(AIC)选择最佳模型,只有显著的路径被保留。路径宽度表征SPC大小。假设1的路径着深绿色,假设2的路径着深红色。在模型中,Bray-Curtis差异性用来表示土壤生物群落,Jaccard差异性用来表示植物群落。
讨 论
根据本研究中网络分析的结果,真菌、细菌是最大的两类生物群,拥有最多的边数和节点数(图1)。尽管如此,细菌和真菌的单界网络的拓扑结构完全不同:细菌网络的负连接比例是真菌网络的四倍,平均连通度则是真菌的8倍 (图1B, 表1),这表明细菌具有高度的自组织能力,但种内竞争强烈,真菌之间的关系则更倾向于合作与共存。
与我们的假设1一致,多界网络显著提升了界内连接的数量、平均连通度和负连接比例(表2,图1和2)。特别是,真菌的平均连通度增加了3倍,负连接比例增加4倍。平均连通度的增加表明当其他营养级生物增加时,网络复杂度增高。该发现与多样性网络复杂度正相关的共识相一致。负边比例的增加则表明,当多界网络与单界网络相比较时,种间竞争加剧。
氮是影响林线土壤微生物生长和多样性的重要限制性元素。不论在多界还是单界网络中,腐生真菌和EcM真菌间的负连接比例都显著高于其他真菌类群间连接的比例。这可能与“Gadgil effect”有关,即EcM真菌直接从有机物中获取氮素,导致腐生菌生长的氮限制。两类原核生物关键物种,行使氨氧化功能的亚硝化球菌(模块中心节点)和具有固氮功能的地杆菌(网络中心节点),均与森林的氮循环高度相关。这些发现使我们相信:微生物网络拓扑结构和土壤生物地球化学过程紧密关联。在土壤生物地球化学循环过程中扮演重要角色的微生物同样可能是多界生物群落中的关键物种。之前,我们也观察到土壤微生物的功能多样性(尤其是C和N循环相关基因)在林线过渡区急剧提高。
与我们的假设2一致,真菌群落强烈地影响多界网络的连通和稳定性。在节点水平,真菌的度和中介性显著高于细菌(图3)。更高的度参数表明某一真菌的扩增子序列变种(ASV)连接了更多的其他ASVs,而更高的中介性参数表明该真菌更有可能成为关键“中介”。先前,在人肺和皮肤系统中的细菌-真菌联合网络中,真菌相比细菌具有更高的中介性和度。在整个多界网络中,真菌的界内连接只有771条,而跨界连接高达到5487条,因此,真菌的重要性主要体现在其跨界连接而非界内连接。与真菌的随机化的连接相比,真菌更倾向与植物(+6.4%)、古生菌(+3.5%)和线虫(+2.0%)建立连接。这里,在真菌与植物的连接中正边的比例最高(77.5%),而在真菌与古菌的连接中负边的比例最高(40.8%)(图5)。先前,真菌与植物在多样性和群落组成上被报道高度正相关,并且随着植物系统发育距离的增加,植物周遭的真菌群落的差异性也显著增加。本研究在网络水平上进一步证实了真菌和植物的显著关联。真菌与古菌的相关性可能源自它们对好氧和厌氧环境的不同生态位偏好。
真菌对多界网络的另一个显著影响是“稳定器”效应。当真菌网络被添加到植物、线虫、细菌或古菌的单界网络上时,会使这些网络连接变得更加紧密且模块化降低(图4A,表S2)。真菌网络的添加也提高了植物、线虫和古菌网络的稳定性(图4B)。值得注意的是,真菌自身的单界网络非常稳定,其自然连通性随节点丢失降低的斜率绝对值只有0.005,而植物、细菌和古菌斜率绝对值分别为0.018、0.024和0.021(图S5A)。真菌可能通过自身网络的稳定性为多界网络提供“基本的骨架”,从而支撑整个生物网络系统的稳定性。在先前的报道中,真菌在干旱草地系统中的网络稳定性显著高于细菌。这里,当我们把真菌网络从多界网络中移除后,网络的自然连通性整体下调(图S5B),平均连通度和边数也大幅度降低,网络向模块化方向转变(表S2)。
在真菌群落内部,EcM真菌网络比non-EcM真菌网络具有更高的连通性,这可能与林线生态系统中EcM真菌物理网络的优势有关(更多基于传统意义上的菌根网络)。高度连通的EcM真菌网络或许有利于岳桦种群在林线的定植和扩散。此外,EcM和non-EcM真菌对多界网络的影响无显著差异,EcM和non-EcM真菌网络的单独的添加都提高了植物、线虫、古菌网络的稳定性和连通性,但是这种提高的程度要弱于整体真菌群落的添加。因此,我们建议在网络分析和制定保护策略时,将真菌群落作为一个整体考虑,这可能与传统真菌群落生态学分功能类群考虑的思路有所差别。
除了多界网络分析的结果外,MRM和SEM也都表明了植物群落对真菌群落的强烈影响,而真菌群落进一步显著影响古菌和线虫群落,反之亦然(图6B,表S8)。真菌群落并不直接影响植物群落,这与我们之前的在高寒草原的研究结果类似。此外,真菌群落和细菌群落之间缺乏直接关联,这与先前全球土壤微生物组的研究结果不同。尽管如此,真菌仍然可以通过影响线虫和古菌群落间接影响细菌(图6B),真菌与细菌的跨界连接的占比也是最大的(图5)。综上,本研究展示了真菌群落是多界群落互作的“中心”,是连接地下和地上生物群落的“桥梁”。例如,研究发现:植物群落通过根系物质调控EcM真菌的群落和生物量,而真菌群落的变化进一步通过降低食真菌线虫的比例影响线虫群落。
最后需要注意的是,我们推断的多界网络关系源自统计学分析,而非通过直接的生物互作实验得出。尽管多界网络分析正在推动我们对不同生物界物种的在多界群落中作用的理解,然而多界网络在多大程度上代表了真正的生物间的互作关系,这仍然是一个值得探讨的问题。使用机器学习算法和基于特征性状的预测分析是未来的该领域的重要研究方向。此外,实验验证也是提高网络分析可靠性的有效手段,虽然其往往只能聚焦有限的交互物种和较窄的生态幅。
结 论
在网络和群落水平上,研究明确了(1)土壤真菌包括EcM真菌、AMF、腐生真菌及其他真菌类群在多界网络中共同行使“中介”作用。当真菌网络加入植物、古菌、线虫和细菌网络时,其网络连通性和稳定性显著提高,模块性降低。特别是,真菌倾向建立跨界以及跨模块之间的连接。(2)土壤真菌群落在多界群落中扮演“桥梁”的角色。真菌群落位于多界生物群落的中心,连接植物和土壤生物。本研究揭示了真菌群落及其在生物互作过程中的重要作用(特别是EcM真菌),为高寒林线生态系统及其他相近的生态系统应对全球变化,妥善制定生态保护策略提供了重要参考。
方 法
· 研究区域、样品采集和植被调查
研究区域位于中国东北长白山北坡。在该区域,岳桦生长在海拔1700-2100米的范围内,在山的上部形成了从密闭森林到高山苔原的广阔的林线交错带。沿交错带,我们选取了30株成熟岳桦(海拔范围1688-2113m),在其周围采集土壤样品(图S9A)。采集时,以树干为中心,胸径为距树干的距离,移除地表凋落物后,用土钻采集4个土芯(直径=3.5 cm,深度=10 cm),混合为一份土壤样品(图S9B)。同时调查记录每株岳桦邻近样方中的植物群落组成和覆盖度,包括乔木、灌木和草本(图S9B),在本研究中,岳桦周遭植被群落沿海拔显著变化(图S10),植物丰富度随海拔呈U型曲线,中海拔地点丰富度最低 (图S11)。
岳桦树木的相关参数记录如下:种群密度(树木调查样方中的岳桦个体数)、凋落物厚度、树高、冠幅、胸径以及选定的岳桦树木个体距离森林边界的距离。此外,我们测定了细根的碳、氮、磷、钾、钙、镁、锰、铝、铁、碳氮比、氮磷比、木质素、纤维素、半纤维素、糖、蛋白质、游离氨基酸和游离脂肪酸含量,并测定了土壤的湿度、pH、电导率、硝态氮、氨态氮、DOC、DON、总碳、总氮、总磷、碳氮比、氮磷比、总钾、总钙、总镁、总锰、总铝、总铁、有效磷、有效钾、有效钙、有效镁、有效锰、有效铝、有效铁以及粘粉砂的比例。测定方法参照前期研究,数据详见图S12和S13。
· 分子分析
采用改进的贝尔曼漏斗法富集和分离线虫群落。基于线虫的活动性,将50g土壤(过2mm筛)浸入50 ml无菌水中,在25°C下孵育48 h。土壤浸出液(包括活线虫)收集于50ml离心管中。每个样品收集2管线虫悬液,然后9000g离心20 min,将2管线虫离心底物合并成一份样品,冷冻保存用于DNA提取。此外,取0.5 g过筛土壤,用以提取真菌、细菌和古菌的DNA。使用土壤试剂盒FastDNA Spin kit for Soil提取土壤生物总DNA。
我们使用引物 NF‐1(GGTGGTGCATGGCCGTTCTTAGTT)/18Sr2b(TACAAAGGGCAGGGACGTAAT)扩增18S小亚基(SSU)基因,靶标线虫群落;采用ITS1‐F(CTTGGTCATTTAGAGGAAGTAA)/ITS2(GCTGCGTTCTTCATC GATGC)扩增ITS1片段,靶标真菌群落;针对球囊菌门(Glomeromycota)采用两步法PCR扩增(第一个循环引物为AML1 (ATCAACTTTCGATGGTAGGATAGA)和AML2(GAACCCAAACACTTTGGTTTCC),第二个循环引物为AMV4.5NF(AAGCTCGTAGTTGAATTTCG)和AMDGR(CCCAACTATCCCTATTAATCAT);采用515 F (5’‐GTGCCAGCMGCCGCGG‐3’)和907 R(5’‐CCGTCAATTCMTTTRAGTTT‐3’)扩增16 S rRNA 基因,靶标细菌;采用524F10extF(TGYCAGCCGCCGCGGTAA)和 Arch958RmodR (YCCGGCGTTGAVTCCAATT)扩增,靶标古菌。PCR产物标准化为等摩尔量后,在Illumina MiSeq PE300平台(美吉公司)测序。
使用QIIME2处理原始数据,获取ASV表。利用Trimmomatic过滤平均质量分数<20或读长<80bp的原始序列,采用FLASH软件拼合序列。使用DADA2算法去噪,并生成ASVs。SILVA SSU 138用作线虫、细菌和古菌分类的参考数据库(https://www.arb-silva.de/)。在分类比对前,使用q2‐feature‐classifier结合线虫、细菌和古菌的不同引物对SILVA SSU 138数据库进行训练。使用MaarjAM online的BLAST方法对AMF的ASVs进行分类对比(http://maarjam.botany.ut.ee/)。采用Unite v8.0(http://unite.ut.ee)作为真菌分类学的参考数据库。真菌分类对比前,同样使用q2‐feature‐classifier结合ITS1‐F/ITS2引物进行数据库的训练。
当去除ASVs中的非目标序列后,我们获得了77955条线虫序列,1184347条真菌序列,562808条AMF序列,148628条细菌序列,895426条古细菌序列,分别对应246、2081、182、10165、和333个 ASVs。当重抽样至每个样品的最小序列,并合并真菌和AMF的ASV表后,最终保留了4个线虫、真菌、细菌和古菌的ASV表(表S9)。真菌功能类群注释采用FUNGuild软件。
· 统计分析
统计分析在R v4.1.0和AMOS 21.0 (AMOS IBM)中完成。首先,线性、二次和三次回归模型用于确定邻近植被(如丰富度和覆盖度)、岳桦相关因子以及土壤属性沿海拔梯度的变化,根据AIC选择最优模型(表S10-S12)。采用vegan包的Permutational Multivariate Analysis of Variance检测邻近植物群落的显著变化。共线变量(r>0.7)去除后,40个变量被保留,包括7个邻近植物的变量、15个岳桦相关因子和18个土壤属性(图S8),后续分析基于上述40个变量开展。
采用SPIEC‐EASI的扩展法构建植物、线虫、真菌、细菌和古菌的多界网络。采用SPIEC‐EASI方法构建植物、线虫、真菌、细菌和古菌的单界网络。SPIEC‐EASI对群落组成结构造成的偏差具有鲁棒性。在网络分析中,在<5个样品中出现的ASVs被去除(表S9)。包含102个种的植物物种表(存在/缺失)也被用于网络分析。网络拓扑参数,包括节点数、边数、平均连通度、模块性、平均路径长度和正负连接的比例,被选择用以比较不同的网络。其中,节点数、边数、平均连通度、模块性和平均路径长度采用igraph包计算;正负连接的比例采用Gephi V0.9.2计算。网络图形的呈现和绘制也采用Gephi。节点属性,包括度和中介性的计算通过igraph包完成。为了比较不同生物界的度和中介性,首先根据de Vries等的方法,对度和中介性进行转化,而后使用pgirmess 包中的kruskalmc函数检验它们的差异性。根据节点在模块内和模块间的连接情况,将归属植物、线虫、真菌、细菌和古菌的节点划分为以下四类:外围节点(peripheral),连接节点(connector),模块中心节点(module hub)和网络中心节点(network hub)。此外,通过逐步去除50%的节点来评估网络自然连通性下降的速率(即判定网络稳定性),通过此方法评估不同单界网络的稳定性的差异,同时通过添加或删除真菌、线虫、细菌和古菌网络,观察生物网络稳定性的变化。为比较EcM和non‐EcM真菌在共存网络中的作用,我们也分别对EcM和non‐EcM真菌进行了相似的网络分析。
本研究也分析了多界网络中真菌与植物和其他土壤生物连接的偏好程度。根据植物和其他土壤生物的节点数,首先计算出它们与真菌连接的预期比例。随后,计算观察到的真菌连接比例与预期连接比例之间的偏差,以此表示对真菌连接的偏好程度。此外,基于Erdos-Reyni模型,为真菌单界网络和多界网络中的真菌界内网络各生成999个具有相同节点和边数(包括固定的正:负边比例)的随机网络。统计出腐生菌和EcM真菌以及真菌之间其余连接的负边比例。为了能够对包含不同真菌功能类群的网络进行横向比较,我们进一步将负边比例进行了Z值标准化,借此控制了物种丰富度和连接数的变化。负边比例的Z值定义为Z=(Vobserved−Arandomized)/SDrandomized,其中Vobserved是观察值,Arandomised和Sdrandominized是999个随机化矩阵的平均值和标准差。
为了检测植物、线虫、真菌、细菌和古菌在群落水平的相互关系,我们构建了两种MRM模型(即MRM#1和MRM#2)。在MRM#1中,40个非共线性的变量、地理距离和邻近植物群落被当做微生物和线虫群落组成的预测因子。在MRM#2中,我们则进一步添加了土壤线虫、真菌、细菌和古菌群落组成作为其他土壤生物群落组成的预测因子。通过比较两种MRM模型的解释率,确定了土壤生物群落之间的相互作用是否显著影响各自的群落组成。最后,我们基于两个假设构建了SEM的先验模型:(1)植物群落通过影响土壤属性驱动土壤生物群落(包括真菌);(2)真菌群落影响植物和其他土壤生物群落,同时植物和其他土壤生物群落也显著影响真菌群落;基于AIC和AMOS的其他统计参数获得最优模型,从整体上展示群落与群落之间的相互关系。
引文格式:
Teng Yang, Leho Tedersoo, Xu Liu, Gui‐Feng Gao, Ke Dong, Jonathan M. Adams, Haiyan Chu. 2022. Fungi stabilize multi‐kingdom community in a high elevation timberline ecosystem. iMeta: e49. https://doi.org/10.1002/imt2.49
作者简介

杨腾(第一作者)
● 中国科学院南京土壤研究所副研究员、硕士生导师,中科院青年创新促进会会员
● 从事真菌生态学、真菌多样性及其生物地理分布研究。以第一作者在The ISME Journal, New Phytologist, SCIENCE CHINA Life Sciences,iMeta,Soil Biology and Biochemistry等期刊上发表论文15篇(含1篇ESI高被引论文),总被引1214次,H指数19。担任Frontiers in Microbiomes副编辑、iMeta青年编委

褚海燕(通讯作者)
● 褚海燕,中国科学院南京土壤研究所二级研究员、博士生导师,中国科学院大学“土壤生物学”首席教授
● 2000年于中国科学院南京土壤研究所获博士学位并留所工作。长期从事土壤微生物学、微生物生态学方面的研究工作。发表SCI论文160余篇,其中第一或通讯作者论文98篇。担任中国土壤学会土壤生物和生化专业委员会主任,Soil Ecology Letters共同创刊主编,iMeta、Microbiome副主编,The ISME Journal、mSystems等6种国际期刊编委, 《微生物组实验手册》特邀主编。2019年入选全球“环境科学”高产作者TOP100,2019年以来连续入选科睿唯安 “全球高被引学者”, 2020年以来连续入选爱思唯尔“中国高被引学者”。获得中国土壤学会科学技术奖一等奖(排名第一),江苏省科学技术奖二等奖(排名第一),中国科学院优秀导师奖