研究背景
作为一种固氮丝状蓝藻,拟柱孢藻(Raphidiopsis raciborskii, 原名为Cylindrospermopsis raciborskii)已在约18%的淡水湖泊,水库和河流中被报道形成水华。系统学和生物地理学观点认为,拟柱孢藻最早起源于热带或亚热带地区。然而,近几十年来,中纬度的温带地区,甚至北纬57°的高纬度地区均发现拟柱孢藻及拟柱孢藻水华。此外,有些拟柱孢藻能产生拟柱孢藻毒素(CYN)、石房蛤毒素(STX)等多种毒素,对水生态系统和人类健康具有潜在危害。
以往的研究表明,拟柱孢藻具有许多竞争取胜的有效策略,如:对溶解性无机磷的高效吸收、亲和及储存能力,以及具高效的溶解性有机磷利用能力。拟柱孢藻对氮的灵活利用策略,它不仅自身可以固氮,也可以利用氨、硝酸盐或尿素作为其氮源。同时,该物种也能耐受高浓度的溶解性矿物质(如:高钙和硫酸盐浓度),并对温度和光具有广泛的耐受性。此外,最近研究表明拟柱孢藻产生的CYN也可能是其竞争获胜的策略之一。因此,拟柱孢藻的表型可塑性、种间变异性和环境适应性加剧了其在全球范围的扩张。然而,这些特征都不能清楚地解释为什么拟柱孢藻如此大范围的扩张。
温度被认为是影响浮游植物生长和驱动浮游植物生态型变化和保持优势的重要环境因素。在全球变暖背景下,拟柱孢藻对温度变化的响应存在着截然不同的观点,因此,考虑到全球变暖的生态重要性,阐明拟柱孢藻对不同温度梯度产生的相似或不同的响应将能更全面地理解该物种的传播和扩张。
因此,本研究以拟柱孢藻 FACHB-1096藻株为研究对象,通过创建了系列温度梯度,并监测其生长、光合、相关酶活及代谢产物等变化。我们的研究结果表明,温度能显著调节拟柱孢藻细胞的生长、细胞尺寸和代谢物三者的权衡关系,这为其在温带水体全球扩张提供了基础。
研究结果
(1) 生长和形态
与对照组(32 °C)相比,在20°C,15°C和10°C下的细胞活性和比生长速率(μ)分别显著降低0.67、0.74和0.57倍,以及 0.29、0.17和0.56倍(p < 0.05,图S1a和S1b)。线性拟合表明,拟柱孢藻的细胞活性和比生长速率与温度呈显著正相关(p < 0.001,图1a和1b)。异形胞的比例随温度下降显著降低,并与温度呈显著正相关(p < 0.001,图1c 和S1c),而厚壁孢子的数量随温度升高而显著增加,与温度呈显著负相关(p < 0.001,图1d和S1d)。在大约20 °C时发现藻丝长度,细胞体积和长宽比的值最高。与32 °C相比,20 °C时的藻丝长度、细胞体积和长宽比分别显著增加了1.56倍、1.74倍和1.28倍(p < 0.001,图 S1e和S1f)。
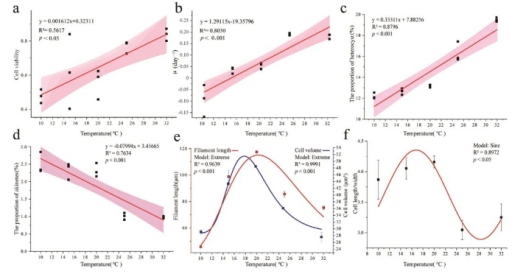
图1 温度与细胞活性(a)、比生长率(b)、异形胞比例(c)、厚壁孢子比例(d)、菌丝长度、细胞体积(e)和细胞长宽比的相关性(f)。
(2)叶绿素a 荧光
与32 ℃和25℃处理相比,20℃、15℃和 10℃处理组归一化的叶绿素a荧光诱导曲线(OJIP)的J相明显增加,10℃时OJIP曲线的I点消失(图2a)。与32 ℃处理相比,10℃时的Fv/F0、Fv/Fm、φP0、ψ0、φE0以及PIABS均显著下降。(p < 0. 05,表S1),而在J点的相对可变荧光强度(Vj)显著增加(表 S1,p < 0.05)。结果还表明,10 °C和32 °C时的单位细胞叶绿素含量略高于15 °C、20 °C和 25 °C处理组,但它们之间并没有显著差异(图2c)。简化的膜模型显示,每个反应中心的TR0/RC在20 ℃和15 ℃处理中显著增加,ABS/RC和DI0/RC在10 ℃处理中显著增加,而ET0/RC在10 ℃处理中相对32 ℃处理显著下降(p < 0.05,图2d)。
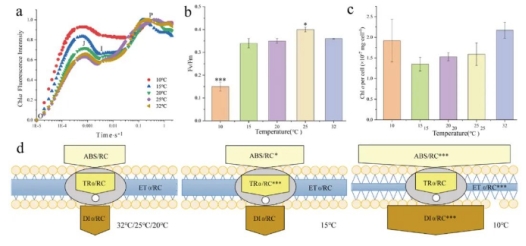
图2 不同温度下拟柱孢藻的叶绿素a荧光。(a)OJIP,叶绿素a荧光曲线;(b) 光能转换效率(Fv/Fm);(c)单位细胞叶绿素a含量;(d)基于JIP的简单能量流动膜模型。
(3)氧化胁迫
将拟柱孢藻接种到10 ℃处理中时,活性氧(ROS)和过氧化氢酶(CAT)的活性与32 ℃处理相比分别显著增加了2.95倍和4.65倍(p < 0.01,图3a 和3d)。同样,在10 ℃和15 ℃处理中,丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性也明显增加。结果表明,与32 ℃的对照组相比,MDA和SOD水平分别显著增加了1.67、1.56倍和1.71、2.69倍(图3b 和3c,p < 0.001)。
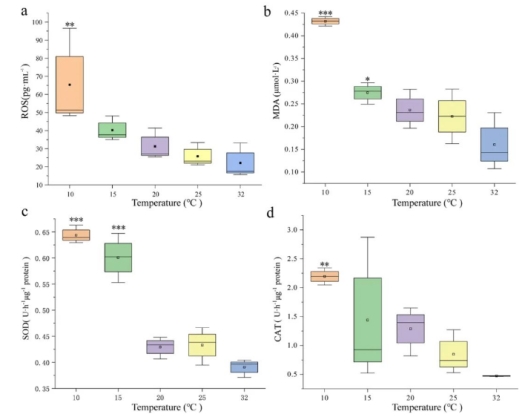
图3 不同温度下拟柱孢藻的氧化应激。(a)活性氧(ROS);(b) 丙二醛(MDA);(c) 超氧化物歧化酶(SOD);(d)过氧化氢酶(CAT)。
(4)代谢组学
基于LC-MS非靶向代谢组学,在不同温度梯度下共获得860个阳离子和735个阴离子代谢物。在这些代谢物中,有245个阳离子代谢物和226个阴离子代谢物可以通过KEGG进行注释。主成分分析(PCA)表明,10 ℃、15 ℃、25 ℃和 32 ℃处理组能够较好的分离(图 4a 和 4c)。KEGG 结果显示,阳离子和阴离子代谢物所注释的代谢途径大致相似。这些代谢物包括核苷、核苷酸和类似物、生物碱及其衍生物、笨类、脂质和类脂质分子、有机酸及其衍生物、有机氮化合物、有机氧化合物、有机杂环化合物、有机氧化合物、苯丙烷和聚酮化合物、木脂素、新木脂素和相关化合物等,分别归属环境信息过程(Environmental Information Processing)、基因信息过程(Genetic Information Processing)和代谢(Metabolism)等一级代谢通路(图 4b 和 4d)。
在 PLS-DA 分析中,25 °C、15 °C和10 °C组的代谢物与对照组(32 °C)相比存在显著差异(图 S2)。在25 ℃、15 ℃ 和10 ℃ 处理中,分别有135个(81个上调,54个下调)、501个(188个上调,313个下调)和360个(193个上调,167个下调)代谢物发生显著变化。此外,在10 °C时,富集了淀粉和蔗糖、嘧啶和谷胱甘肽代谢,在15 °C时,富集了色氨酸代谢、淀粉和蔗糖代谢、ABC转运体、苯丙氨酸、酪氨酸和色氨酸生物合成、果糖和甘露糖代谢以及磷酸戊糖途径,而抗坏血酸和醛糖代谢、淀粉和蔗糖代谢、果糖和甘露糖代谢、C5-支链二羧酸代谢和 2-氧代羧酸代谢则在25 ℃时富集(图 S3)
与32 °C处理相比,淀粉和蔗糖代谢在10 °C、15 °C和25 °C时的表达上调了1.38~5.09倍(图5)。其中,D-葡萄糖-6P、D-葡萄糖和海藻糖-6P在15 ℃时的表达水平分别是32 ℃时的3.00倍、3.01倍和3.07倍。此外,与对照组相比,5种(参与淀粉和蔗糖代谢途径)、9种(参与嘧啶代谢途径)和5种(参与谷胱甘肽代谢途径)化合物在10 °C时显著富集,而还原型谷胱甘肽、抗坏血酸和维生素C在10 °C时显著下调(p < 0.05)。与对照组相比,有 11个(色氨酸代谢途径)、5种(淀粉和蔗糖代谢途径)、11种(ABC 转运体)、6种(苯丙氨酸、酪氨酸和色氨酸生物合成途径)、3种(果糖和甘露糖代谢途径)和 4种(磷酸戊糖途径)化合物在15 °C时显著富集,其中20种代谢物上调,17种代谢物下调(p < 0.05)。然而,与对照组相比,3种(抗坏血酸和醛酸代谢途径)、3种(淀粉和蔗糖代谢途径)、2种(果糖和甘露糖代谢途径)、3种(C5-支链二元酸代谢途径)和4种(2-氧代羧酸代谢途径)化合物在25 ℃处理组显著上调(p < 0.05)。
代谢组学的进一步分析显示,与对照组相比,共有49种差异代谢物在10 ℃、15℃ 和25 ℃ 处理中共同表达(图 S4)。49种代谢物中有14种化合物(10种上调,4种下调)被KEGG注释到8条二级代谢途径,包括氨基酸代谢、碳水化合物代谢、全局和概览图、膜转运、辅因子和营养代谢、核苷酸代谢、能量代谢和异种生物降解与代谢(表S2,图S5)。与32 ℃相比,尿酸、蔗糖、还原型谷胱甘肽、海藻糖和苯乙酰谷氨酰胺的表达水平随温度的降低而上调,它们的表达量分别上调了7.80、5.09、3.08、2.80和2.43倍。在15 °C时,D-核酮糖-5P、7,8-二氢生物嘌呤、2-糠酸、香草酸和海藻糖-6P的表达水平最高,而黄嘌呤核苷、2'-脱氧胞苷和 5-甲基胞嘧啶的表达水平最低(图 S5)。

图 4 不同温度下培养的拟柱孢藻新陈代谢的主成分分析和代谢物注释。(a)阳离子代谢主成分分析;(b)阳离子代谢物注释;(c)阴离子代谢主成分分析;(d)阴离子代谢物注释。
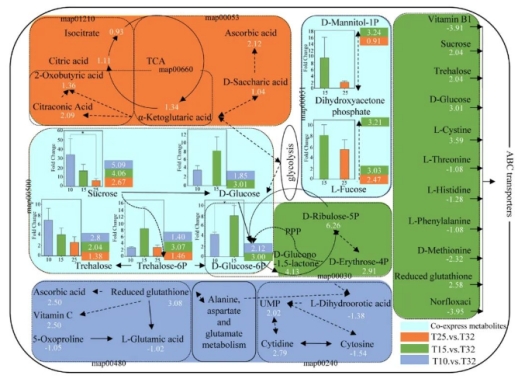
图 5 与对照组相比,拟柱孢藻在不同温度处理下显著富集的代谢途径中不同代谢物的表达概况。不同颜色代表相应温度下的代谢物。虚线框代表不同的代谢途径。虚线箭头表示化合物的间接生成,实线箭头表示化合物的直接生成。代谢物之间的显著差异分析采用取对数前数据进行单因素方差分析。正负数字分别代表上调和下调的倍数。
(5)细胞权衡
在不同温度下,拟柱孢藻的生长、细胞大小(菌丝长度、细胞体积和长宽比)和代谢物(蔗糖、海藻糖、海藻糖-6P、葡萄糖、葡萄糖-6P、果糖、甘露醇和还原型谷胱甘肽)之间存在权衡。在低温(10 °C)下,拟柱孢藻的细胞大小、光合作用和生长明显下降,而代谢物(包括海藻糖、蔗糖和谷胱甘肽)则明显增加。在中温条件下(15 °C 和 20 °C),拟柱孢藻的藻丝长度最长,光合作用能力基本正常,生长速度稍慢,但与PPP相关的代谢物,即D-核酮糖-5P、7,8-二氢生物嘌呤、2-糠酸、香草酸和海藻糖-6P 显著增加。然而,在较高温度下(25 °C和32 °C),虽然细胞体积减小,但光合作用、生长和TCA循环却增强了。
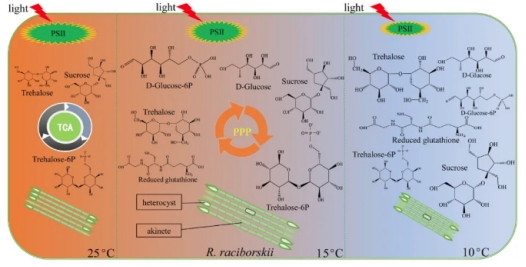
图 6 拟柱孢藻的生理、生化、形态和主要代谢物随温度变化的图形摘要。颜色从左到右的变化表示温度逐渐降低,不同温度下代谢物分子式的大小按照代谢物表达量的比例绘制(32℃为对照)。
总结与展望
拟柱孢藻对温度具有广泛的适应性,可在约10 °C以上的温度下持续生长,其最佳生长温度和光合效率约为25 °C。拟柱孢藻细胞的生长、细胞大小和代谢物之间对不同温度的权衡表明,它在细胞资源分配方面表现出的灵活性,可以使其向中纬度河流和湖泊扩展。已有的研究表明,拟柱孢藻对光、温度、磷和无机碳的生理和分子反应具有高度可塑性,毒素细胞配额也存在较大差异。虽然在本研究表明拟柱孢藻对不同温度的细胞权衡策略,但是不同地区和水体中分离出来的拟柱孢藻藻株如何应对温度变化则需要进一步研究。此外,本研究只深入探讨拟柱孢藻在短期温度变化时的细胞权衡策略。但在考虑对温度变化对拟柱孢藻的适应和驯化效应或基于个体拟柱孢藻的全球规模预测时,则需要精密设计一个综合研究,即小型、大型和生态系统规模的控制实验、实地观测和模拟建模以及长期观测。以此同时,要全面了解拟柱孢藻的扩张策略,也需要特别关注温度变化和营养富集耦合作用对拟柱孢藻扩张的共同影响。
专家建议:在文章结论中似乎可以加上拟柱胞藻具有一种特殊的“人工智能”,具有极强的温度适应性,并且因为其在地表水体中表现为不同于其他水华藻类的土色,反而更容易被监测和管理部门忽视。
研究团队及项目资助
本研究由西南大学生态与环境教育部重点实验室完成,西南大学博士研究生郑保海为论文第一作者,西南大学吴忠兴教授为论文的通讯作者。相关研究结果以“Does temperature favour the spread of Raphidiopsis raciborskii, an invasive bloom-forming cyanobacterium, by altering cellular trade-offs?”为题发表于海洋和淡水生物领域一区期刊Harmful Algae(https://doi.org/10.1016/j.hal.2023.102406)。
该研究得到国家自然科学基金项目(42177055, 41877410)的资助。本研究数据集中Raphidiopsis raciborskii FACHB-1096藻株来自国家水生生物种质资源库—淡水藻种库。